Pretendemos que este blog sea una herramienta con la cual todos podamos compartir e intercambiar ideas. Te invitamos a aportar materiales, información, videos, fotos, etc para construir el blog, se publicarán con tu nombre.
¿qué información necesitas?
- 1ºPrincipio (2)
- Arquímedes (1)
- Lavoisier (2)
- Virus VIH (1)
- aceite (3)
- agua (2)
- aquanators (1)
- calibre (1)
- calor (1)
- cambio climático (2)
- cambio físico (2)
- cambio químico (3)
- ciclo del agua (2)
- combustibles fósiles (3)
- código QR (1)
- elemento químico (2)
- energía (7)
- espejos (1)
- fuentes luminosas (1)
- gaseoso (3)
- ideas (1)
- instrumentos de medida (1)
- insulina (1)
- isomería óptica (3)
- jabón (2)
- laboratorio (10)
- lasik (1)
- lentes (3)
- luz (1)
- luz polarizada (1)
- líquido (3)
- medio ambiente (3)
- micelas (1)
- molienda (2)
- movimiento perpetuo (1)
- máquina de vapor (1)
- ojo (3)
- petróleo (1)
- plástico (1)
- poder emulsionante (1)
- polarimetría (1)
- propiedades (3)
- proteínas (2)
- quimiteca (4)
- reacciones químicas (1)
- reciclar (2)
- refinería (1)
- reflexión (1)
- separación de mezclas (1)
- sólido (3)
- tabla periódica (4)
- termodinámica (2)
- termómetro (1)
- trabajo (1)
- volumen (1)
10.11.09
16.10.09
Creatividad investigando una reacción química, alumnos 6°CB 2009
La reacción química es: H2O2(l) --> H2O(l) + 1/2 O2(g)
Los grupos trabajaron diseñando diferentes equipos que permitieran estudiar desde el punto de vista cinético el proceso.
Grupo 1 Este grupo armó cuidadosamente el equipo de modo de evitar pérdidas del gas con el objetivo de medir el VOLUMEN de OXÍGENO obtenido.
Colocaron la mezcla en un tubo de ensayo que conectaron a un tubo de desprendimiento.
La reacción ocurre en frío, el baño de agua tiene como función colocar el termómetro para determinar la temperatura del sistema.
.jpg) El oxígeno gaseoso obtenido se recoge por desplazamiento de agua.
El oxígeno gaseoso obtenido se recoge por desplazamiento de agua.Midieron el tiempo de reacción transcurrido al obtener 5mL, 10mL, 15mL, etc de oxígeno.
.jpg) Grupo 2 Este grupo diseño el equipo de modo de contar las burbujas de oxígeno gaseoso formado, conectando un tubo de desprendimiento a una jeringa que contiene la mezcla de reacción y manteniendo el extremo sumergido.
Grupo 2 Este grupo diseño el equipo de modo de contar las burbujas de oxígeno gaseoso formado, conectando un tubo de desprendimiento a una jeringa que contiene la mezcla de reacción y manteniendo el extremo sumergido.En intervalos de tiempo regulares anotaron las burbujas desprendidas.
27.9.09
INSULINA
SECRESIÓN: La insulina se produce en el páncreas como un polipéptido precursor (preproinsulina) que luego se modifica como se indica en la figura:
http://escuela.med.puc.cl/publ/TemasMedicinaInterna/insulinas.html
FUNCIÓN: La insulina interviene principalmente en el anabolismo de los carbohidratos. La deficiencia de insulina provoca la diabetes mellitus y su exceso provoca hiperinsulinismo con hipoglucemia.

ESTRUCTURA: La insulina es sintetizada y almacenada en el cuerpo en forma de un hexámero, es decir, una unidad compuesta por seis insulinas. Sin embargo, su forma activa es la de una hormona monomérica, es decir, la molécula de insulina sola.

http://es.wikipedia.org/wiki/Insulina
ANTECEDENTES: Durante muchos años la insulina que se ha empleado para el tratamiento de la diabetes, se extraía del páncreas de diversos animales, principalmente del buey (Insulina bovina), y sobre todo del cerdo (Insulina porcina). La insulina porcina es casi idéntica a la insulina humana y posee el mismo efecto sobre el azúcar en sangre.

En la actualidad las insulinas que se tiende a emplear son las denominadas humanas, que son químicamente iguales a la del hombre y se obtienen bien de ciertas bacterias y levaduras mediante técnicas de ingeniería genética o bien a partir de la insulina de cerdo, que mediante un proceso químico adecuado se transforma en insulina igual a la del hombre. La pureza de las insulinas actuales es muy superior a las primitivas, lo que evita reacciones indeseables.
La insulina se destruye en el estómago por eso no puede tomarse por boca y DEBE ADMINISTRARSE EN FORMA DE INYECCIONES. Otras vias de administración (nasal, rectal, et.), son poco eficaces, debido a una absorción parcial e irregular de la insulina.
http://www.monografias.com/trabajos14/insulina/Image505.gif
26.9.09
25.9.09
24.9.09
¿Cómo está formado el ojo? ¿Cómo vemos?
¿Cómo vemos?
- Al mirar un objeto, la luz que lo ilumina y se refleja en el mismo penetra en el ojo.
- Esto provoca que el cristalino se expanda y se contraiga hasta enfocar la imagen invertida del objeto sobre la retina.
- En la retina los estímulos lumínicos impactan sobre los fotoreceptores, que se llaman conos y bastones, los cuales se estimulan y generan impulsos nerviosos.
- Los impulsos nerviosos se transmiten a lo largo de los nervios ópticos y prosigen por las vías ópticas hasta llegar al área visual del cerebro donde la información de ambos ojos se procesa para producir una imagen en 3 dimensiones.
20.9.09
16.9.09
15.9.09
14.9.09
Electrólisis del agua
 La energía eléctrica puede utilizarse para transformar sustancias compuestas, como el agua, en sus componentes, en este caso oxígeno gaseoso e hidrógeno gaseoso, ambas moléculas diatómicas.
La energía eléctrica puede utilizarse para transformar sustancias compuestas, como el agua, en sus componentes, en este caso oxígeno gaseoso e hidrógeno gaseoso, ambas moléculas diatómicas. ¿es importante no tirar basura?



¿Sabías que los animales confunden las bolsas con alimento?
¿Sabías que se mueren porque no pueden digerir las bolsas que comen?
¿Sabías que muchos quedan irremediablemente atrapados en las bolsas y en consecuencia mueren?
Crees que los lugares en los que vives están limpios?
Observa el entorno en el que te mueves: la clase ... los pasillos del liceo ... la plaza ... la parada del bus ...
¿Qué calificación les pondrías considerando la limpieza de los mismos?
¿Cómo podrías mejorar la limpieza de tu ambiente?
7.9.09
R E C I C L A R
(2) Este video nos muestra que es posible hacer con los cd y dvd que ya no sirven
(3) Reciclado de envases plásticos de gaseosa tipo PET. Fabricación de escobas a partir de botellas que se sacan de la basura. Empresa brasilera Kubitz.
2.9.09
Elementos Químicos

En el gráfico se indica la abundancia de los elementos en el cuerpo humano en porcentaje en masa % m/m.
Estos elementos químicos están combinados formando todas las moléculas de las estructuras celulares que componen nuestro organismo.
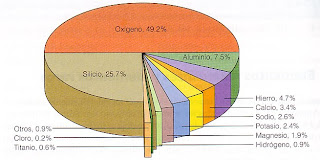
En el gráfico se indica la abundancia de los elementos en la biósfera: la corteza, el agua y la atmósfera, en porcentaje en masa % m/m.

En el gráfico se indica la abundancia de los elementos en el universo en porcentaje de los átomos totales.
Los mismos elementos químicos componen la materia del universo entero, lo que varía es su abundancia según el sistema considerado.
31.8.09
Tabla Periódica
Por ejemplo, tres gases que ya conoces:
el hidrógeno, el nitrógeno y el oxígeno.
Los halógenos, pertenecientes al Grupo 17 (Grupo VII en la notación antigua), también presentan esta característica, sus moléculas están formadas por dos átomos.
El flúor y el cloro son gaseosos a temperatura ambiente, mientras que el bromo es líquido y el iodo es sólido en esas condiciones.
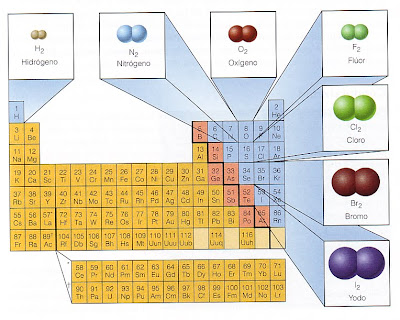 Hay un grupo de elementos que en la naturaleza existen como átomos, son gaseosos, no se combinan excepto en condiciones drásticas. ¿A quienes nos referimos?
Hay un grupo de elementos que en la naturaleza existen como átomos, son gaseosos, no se combinan excepto en condiciones drásticas. ¿A quienes nos referimos?No olvides que en la Tabla Periódica los símbolos químicos tienen un color que indica el estado de agregación del elemento en condiciones ambientales.
Los elementos químicos se clasifican en metales, no metales y semimetales o metaloides. En la Tabla Periódica siguiente se muestran algunos ejemplos
28.8.09
La Tabla Periódica

¿te has preguntado cómo fué organizada? ¿quiénes y cuándo la organizaron?
Esa tarea llevó en realidad varios siglos.
Hay páginas interactivas en las que obtener información de cada elemento en particular.
La primer dirección incluye test y juegos ¡veamos si te animas!
http://tablaperiodica.educaplus.org/
http://www.alonsoformula.com/inorganica/tabla_periodica.htm
http://www.mcgraw-hill.es/bcv/tabla_periodica/mc.html
http://www.webelements.com/uses.html
¿Porqué es rojo el planeta rojo?

Si bien hemos visto brillar a Marte durante este mes, no se ha destacado como se anunciaba. Si alguien utilizó un telescopio para observarlo, podrá decir si vió al planeta más cerca de lo usual. De todos modos, hemos leído comentarios acerca de que esta información falsa, que ha estado recorriendo el mundo vía web desde hace años.
REFLEXIÓN: Siempre es mejor utilizar el tiempo y la energía en cosas útiles o divertidas ¿no lo creen?
Amigos

y charlan contigo en la plaza ...

¿Como funciona un termómetro?
 Hay muchos tipos de termómetros:
Hay muchos tipos de termómetros:Los más comunes contienen un líquido en su interior que se dilata o contrae con los cambios de temperatura. este líquido puede ser mercurio, alcohol coloreado, etc.
Para poder explicar porque ocurre esto, la ciencia recurre a un modelo que nos habla de partículas que no podemos ver: el modelo cinético corpuscular de la materia.
El modelo corpuscular explica que al aumentar de temperatura aumenta la energía cinética media de las partículas que componen la materia, las partículas que componen el líquido coloreado o el mercurio se mueven más deprisa y eso hace que la sustancia se dilate.
En esta figura se muestra un termómetro de jardín, el bulbo que contiene el líquido coloreado va enterrado a nivel de las raíces de las plantas.
¿Cómo fabricar un termómetro? Este link aporta una idea que seguro puedes mejorar: http://centros5.pntic.mec.es/ies.victoria.kent/Rincon-C/practica2/pajita/Termomet/term-2.htm
Relaciones de masa en una reacción química

 El químico sueco J. Jacob Berzelius (1779-1848) realizó la experiencia que se indica en el esquema: calentó una mezcla de plomo Pb (metal blando de color gris) con azufre S (sólido de color amarillo). Obtenía sulfuro de plomo, PbS (sólido color negro brillante).
El químico sueco J. Jacob Berzelius (1779-1848) realizó la experiencia que se indica en el esquema: calentó una mezcla de plomo Pb (metal blando de color gris) con azufre S (sólido de color amarillo). Obtenía sulfuro de plomo, PbS (sólido color negro brillante).Al cambiar las masas de reactivos observó que había una proporción definida entre ellos al combinarse.
La LEY de las PROPORCIONES DEFINIDAS la enunció Proust en 1799: "un compuesto siempre contiene los elementos en ciertas proporciones definidas."

Dalton explicó esta observación con su teoría atómica: "Todos los elementos se componen de diminutas partículas indivisibles llamadas átomos. En las reacciones químicas los átomos no se crean ni se destruyen."
 Esta ley es la base de las fórmulas químicas, cada compuesto químico tiene una proporción definida de elementos que lo forman, lo que hace que sus propiedades sean características y siempre constantes, no importa como se obtenga el compuesto.
Esta ley es la base de las fórmulas químicas, cada compuesto químico tiene una proporción definida de elementos que lo forman, lo que hace que sus propiedades sean características y siempre constantes, no importa como se obtenga el compuesto.27.8.09
24.8.09
¿Cómo doblar un filtro de papel?
Sabías que...
El químico sueco, J.J. Berzelius era un experimentador muy exigente, media cautelosamente lo que utilizaba e inventaba los materiales adecuados para sus experiencias. Es considerado como el inventor del primer papel de filtro efectivo, fue el primero que comenzó a usar papel de composición sumamente pura, como filtro para retener los precipitados en los análisis químicos.
El papel conocido como “papel de filtro sueco” comenzó a fabricarse en 1815, siguiendo sus instrucciones e impuso el estándard para los papeles de filtro utilizados en los análisis.
Ácidos y bases de Arrhenius
HCl(ac) --> H+(ac) + Cl-(ac)
* Base: Sustancia que en solución acuosa produce, o se disocia para formar, iones OH- (hidróxido). Ejemplo:
NaOH(ac) --> Na+(ac) + OH-(ac)
Si se combina un ácido con una base, produce sal y agua:
ÁCIDO + BASE --> SAL + AGUA
Si las proporciones son las adecuadas, el proceso se llama NEUTRALIZACIÓN, los iones se combinan:
H+(ac) + OH-(ac) <--> H2O(l)
Las soluciones acuosas forman parte de nuestra vida cotidiana.
¿Cómo podemos averiguar si una solución es ácida o básica?
¿Cuáles son las propiedades que las diferencian?
¿Qué soluciones ácidas y qué soluciones básicas reconoces en tu entorno?
Escala de pH
14.8.09
¿Cómo se mide un volúmen?
 Es muy importante evitar cometer error de paralaje, por lo que debe ubicarse la vista al mismo nivel que la superficie del líquido.
Es muy importante evitar cometer error de paralaje, por lo que debe ubicarse la vista al mismo nivel que la superficie del líquido. El volumen se mide a la altura de la tangente al menisco que forma la superficie del líquido, como se indica en el dibujo.
Si es posible, se debe estimar, es decir, dividir la distancia entre dos líneas consecutivas de la escala, en forma aproximada, para indicar la última cifra o cifra insegura de la medida.
La MEDIDA debe incluir magnitud, incertidumbre y la unidad. V = 6,24mL +- 0,02mL
13.8.09
DESTILACIÓN

El objetivo principal de la destilación es separar una mezcla de varios componentes aprovechando sus distintas volatilidades, o bien separar los materiales volátiles de los no volátiles.
En la evaporación y en el secado, normalmente el objetivo es obtener el componente menos volátil; el componente más volátil, casi siempre agua, se desecha.
Sin embargo, la finalidad principal de la destilación es obtener el componente más volátil en forma pura.
Por ejemplo, la eliminación del agua de la glicerina evaporando el agua, se llama evaporación, pero la eliminación del agua del alcohol evaporando el alcohol se llama destilación, aunque se usan mecanismos similares en ambos casos.

Equipo para destilación fraccionada.
Técnicamente el término alambique se aplica al recipiente en el que se hierven los líquidos durante la destilación, pero a veces se aplica al aparato entero, incluyendo la columna fraccionadora, el condensador y el receptor en el que se recoge el destilado.
Este término se extiende también a los aparatos de destilación destructiva o craqueo.
Los alambiques para trabajar en el laboratorio están hechos normalmente de vidrio, pero los industriales suelen ser de hierro o acero.
En los casos en los que el hierro podría contaminar el producto se usa a menudo el cobre, y los alambiques pequeños para la destilación de whisky están hechos frecuentemente de vidrio y cobre.
A veces también se usa el término retorta para designar a los alambiques.
12.8.09
9.8.09
¿Cómo se disuelve la sal?

 La mayoría de las sales son cristales iónicos, como la sal de mesa NaCl, están formados por cationes (iones +) y aniones (iones -). Al colocar la sal en agua, las moléculas de agua que chocan con el cristal, separan los iones de éste. Inmediatamente las moléculas de agua, rodean al ión, es decir lo "hidratan"; éste proceso se llama "hidratación" si el solvente es agua y "solvatación" para otros solventes.
La mayoría de las sales son cristales iónicos, como la sal de mesa NaCl, están formados por cationes (iones +) y aniones (iones -). Al colocar la sal en agua, las moléculas de agua que chocan con el cristal, separan los iones de éste. Inmediatamente las moléculas de agua, rodean al ión, es decir lo "hidratan"; éste proceso se llama "hidratación" si el solvente es agua y "solvatación" para otros solventes.Observa en el esquema la orientación de las moléculas de agua en torno a los cationes y a los aniones, ¿Cómo explicas la diferencia?
7.8.09
¿te animás?
 Puedes utilizar una probeta o una botella plástica de 1/2 Litro.
Puedes utilizar una probeta o una botella plástica de 1/2 Litro.Coloca una taza de agua con 10 cucharadas de sal disuelta, agrega una taza de aceite de cocina, unos trozos de papel de aluminio bien compactados (bolitas), uno trozos de corcho, unos trozos de palillos de madera, unos clips.
¿qué ocurre? Puedes tapar y agitar el sistema, luego déjalo decantar ¿qué sucede? ¿Cómo explicas lo observado?
¿Cómo se habrá trabajado para lograr la gama de colores que muestra la probeta del dibujo?
6.8.09
Había una vez un Rey ...
 El Rey de esta historia era cristiano y rápidamente tuvo que huir de los moros cuando éstos conquistaron España. Aunque muy apurado por su vida, no quizo dejar atrás su tesoro, por eso colocó en sus botas la mayor cantidad de monedas de oro que pudo.
El Rey de esta historia era cristiano y rápidamente tuvo que huir de los moros cuando éstos conquistaron España. Aunque muy apurado por su vida, no quizo dejar atrás su tesoro, por eso colocó en sus botas la mayor cantidad de monedas de oro que pudo.Al tratar de cruzar el río, se ahogó.
Lo que el Rey no sabía: la densidad del oro es 19,25 g/mL ¡Es enorme si la comparamos con la del agua! El agua tiene densidad 1 g/mL.
Por ese motivo, sus botas llenas de oro fueron la causa de que se hundiera en el agua... en realidad ¡Lo ahogó su ambición!
El corcho tiene densidad 0,25 g/mL ¿qué ocurre si lo colocamos en agua?
1.8.09
¿Qué gas se forma?
 En algunas reacciones químicas se forman productos gaseosos.
En algunas reacciones químicas se forman productos gaseosos. Es imprescindible conocer la composición de los reactivos, es decir que elementos los forman, así como las características del proceso, para poder sacar conclusiones adecuadas del ensayo de ignición.
El ensayo de ignición consiste en utilizar un palillo o escarbadiente con la punta en ignición y se aproxima a la boca del tubo de ensayo:
* si la ignición se aviva o se enciende el palillo, podemos decir que el gas es oxígeno. (comburente)
 * si se apaga, indica que puede ser dióxido de carbono.
* si se apaga, indica que puede ser dióxido de carbono.* si el gas formado es combustible puede ser un hidrocarburo y se observará una llama amarilla y tizne negro debido al carbón que se forma como producto de la combustión incompleta.
* el hidrógeno puro arde con llama azul, pero si está mezclado con oxígeno se escucha una explosión y la llama es algo amarillenta.
29.7.09
"Nada se crea, ...

... nada se destruye, todo se transforma."
es la Ley de la Conservación de la Masa enunciada por Antoine Lavoisier (1743-1794).
El problema del Rey ¡EUREKA!!
 Había una vez en Siracusa, un Rey llamado Hieron II que le entregó oro a un orfebre para que le hiciese una corona.
Había una vez en Siracusa, un Rey llamado Hieron II que le entregó oro a un orfebre para que le hiciese una corona.Un tiempo después, el joyero le trajo la corona al rey, era muy bonita y por su color parecía de oro, pero alguien lo acusó de haber sustituído parte del oro por plata (metal de menor valor).
 El rey encargó a Arquímedes que comprobase si había sido engañado.
El rey encargó a Arquímedes que comprobase si había sido engañado.El famoso sabio griego resolvió el dilema al introducirse en la bañera para darse un baño y observar que el nivel del agua subía al sumergirse.
La alegría fue tan grande que salió desnudo a la calle gritando ¡EUREKA, EUREKA! (que en griego significa: ¡lo descubrí, lo descubrí!).

¿Cómo lo resolvió?
Arquímedes consiguió un trozo de oro como el que el rey le había dado al orfebre.
En una sencilla balanza de las de la época, (una varilla con un hilo en el centro), de cada lado de la varilla colgó uno de los elementos, la balanza quedó equilibrada: "el orfebre no es tonto, hizo una corona que tiene la misma masa que el oro que le había dado el rey".
Entonces Arquímedes sumergió ambas piezas, la corona y el trozo de oro, en agua.
Si las dos hubieran sido de oro, el volumen desalojado sería el mismo, pero ocurrió que no fue así:
"El Rey tenía razón, el orfebre lo había engañado!!"
PRINCIPIO DE ARQUÍMEDES: todo cuerpo sumergido en un líquido (fluido) experimenta un empuje hacia arriba igual al peso del volumen de líquido desalojado.
Revisemos algunos datos:
la densidad del oro es 19,25 gramos/centímetro cúbico. Si la corona es de oro puro y tiene una masa de 10 Kg, su volumen sería 519,48 cm3.

La densidad de la plata es 10,4 g/cm3. Si la corona es mitad de oro, mitad de plata ocuparía un volumen de 740 cm3. (¿podrías verificar este dato?)
DENSÍMETRO: Es un instrumento de vidrio que sirve para determinar la densidad de los líquidos puros y soluciones.
Se basa en el Principio de Arquímedes.
Consiste en un cilindro hueco con un bulbo pesado en su extremo para que pueda flotar en posición vertical.
La escala está en el interior y la referencia es la densidad del agua pura 1gramo/centímetro cúbico.
Algunos densímetros tienen escalas que indican el % de azúcar en la solución, o el % de alcohol, se llaman "sacarímetros" y "alcoholímetros".
¿Cómo funciona un submarino?
Beakman lo explica del siguiente modo:
28.7.09
FILTRACIÓN - DECANTACIÓN
FILTRACIÓN:
 El método se utiliza para separar una fase líquida de una fase sólida, es decir, separar sólidos que se encuentran dispersos en un líquido.
El método se utiliza para separar una fase líquida de una fase sólida, es decir, separar sólidos que se encuentran dispersos en un líquido. El equipo utilizado para filtrar consiste en embudo, un medio poroso y vaso recolector como se indica en la figura.
El equipo utilizado para filtrar consiste en embudo, un medio poroso y vaso recolector como se indica en la figura.Se utiliza una varilla de vidrio o plástico para dirigir la caída del líquido que se desea filtrar.
El medio poroso puede ser de papel filtro, algodón, tela u otros materiales.
Una forma de doblar el filtro de papel se indica en la figura.
En la filtración puede desearse recuperar la fase líquida, la fase sólida o ambas.
Al comprar papel de filtro debe especificarse el tamaño de poro que se desea.
DECANTACIÓN:
 El método puede utilizarse para separar dos líquidos inmiscibles o separar un sólido de un líquido. En el caso en que se desea separar un sólido que se encuentra disperso en un líquido, éste debe tener la características de “depositarse” en el fondo del recipiente, por ejemplo, podría utilizarse para separar arena de agua.
El método puede utilizarse para separar dos líquidos inmiscibles o separar un sólido de un líquido. En el caso en que se desea separar un sólido que se encuentra disperso en un líquido, éste debe tener la características de “depositarse” en el fondo del recipiente, por ejemplo, podría utilizarse para separar arena de agua. Generalmente es necesario realizar la separación en varias etapas, esperando a que el sólido se deposite en el fondo del recipiente para luego seguir decantándolo.
Estos procesos son utilizados también a nivel industrial, por ejemplo en el tratamiento de “aguas negras”.
Se llama “aguas negras” a aquellas que salen de las casas por las cañerías después de haber sido utilizadas. Observa el esquema prestando atención a las entradas y salidas de las fases en cada paso.
 En una primera etapa el agua pasa por una malla con el fin de separar los objetos grandes.
En una primera etapa el agua pasa por una malla con el fin de separar los objetos grandes.Luego llegan a una enorme cámara donde se filtra por medio de arena y grava.
Posteriormente en un tanque se realiza la decantación: los sólidos suspendidos se depositan y los aceites y las grasas quedan flotando. Luego se somete a un proceso de aireación que provoca el crecimiento de bacterias que descomponen las moléculas orgánicas que aún estén presentes y simultáneamente el oxígeno del aire elimina las bacterias anaeróbicas.
Como consecuencia de estos procesos se generan lodos que se llaman “lodos activados”, que pueden utilizarse como fertilizante.
Finalmente pasan a otro tanque de decantación o asentamiento.
 TU PUEDES FABRICAR UN FILTRO DE GRAVA
TU PUEDES FABRICAR UN FILTRO DE GRAVAEste tipo de filtros atrapan entre los granos de arena las impurezas sólidas. Utiliza un vaso desechable de poliuretano (se usan para tomar café o para los helados), también puedes utilizar una botella plástica cortando la parte superior. Realiza unos agujeros en el fondo del recipiente. Coloca un poco de algodón cubriendo el fondo, una capa de piedritas previamente lavadas, luego una capa de arena limpia y nuevamente una capa de piedras. Vacía lentamente la muestra de agua a filtrar en el equipo de filtración armado y recibe el agua filtrada en un recipiente limpio. Compara el líquido filtrado con la muestra inicial.
.jpg)
.jpg)









