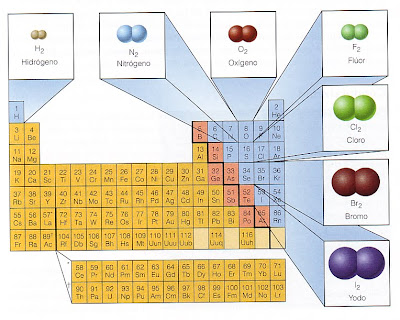
Por ejemplo, tres gases que ya conoces:
el hidrógeno, el nitrógeno y el oxígeno.
Los halógenos, pertenecientes al Grupo 17 (Grupo VII en la notación antigua), también presentan esta característica, sus moléculas están formadas por dos átomos.
El flúor y el cloro son gaseosos a temperatura ambiente, mientras que el bromo es líquido y el iodo es sólido en esas condiciones.
 Hay un grupo de elementos que en la naturaleza existen como átomos, son gaseosos, no se combinan excepto en condiciones drásticas. ¿A quienes nos referimos?
Hay un grupo de elementos que en la naturaleza existen como átomos, son gaseosos, no se combinan excepto en condiciones drásticas. ¿A quienes nos referimos?No olvides que en la Tabla Periódica los símbolos químicos tienen un color que indica el estado de agregación del elemento en condiciones ambientales.
Los elementos químicos se clasifican en metales, no metales y semimetales o metaloides. En la Tabla Periódica siguiente se muestran algunos ejemplos

























